Reacção Química: conceito, condições para ocorrência, equação química e significados qualitativo e quantitativo
Reacção Química
Reacção
química é um
fenómeno químico em que as substâncias iniciais se transformam em novas
substâncias, com novas propriedades (características).
Quando se queima a
vela, observamos a libertação de uma chama clara, de fumos negros, de calor, formação
de cinza, etc., Estas e outras manifestações permitem-nos visualizar e afirmar
que houve transformação na vela.
Embora não sejam
uniformes para todas as reacções químicas, além das manifestações acima
referidas, o decurso de uma reacção química
é traduzido pela alteração da cor das substâncias, do aspecto, do cheiro, do
estado físico, do teor de energia, da formação de precipitado (sólido que se
deposita no fundo do recipiente da reacção), etc.
A partir de uma vela
forma-se uma chama de ardor, gases ou fumos, cinzas e calor, dos quais não
podemos conseguir voltar a formar a vela e, de igual modo, a partir de uma
barra de ferro, com brilho, exposta ao ar ou vapor de água, passa-se a ter
fragmentos acinzentados, bem diferentes da barra de ferro, facto que prova que
houve transformação.
As condições necessárias
para que ocorra uma reacção química são explicadas pela teoria das colisões,
que refere que existe uma reacção quando as partículas iniciais:
- Entram em contacto umas com as outras.
- Chocam entre si.
- Tiverem energia suficiente.
Portanto, quando substâncias
iniciais (reagentes) se transformam em novas substâncias, com novas caracteristicas
(produtos), dizemos que ocorreu uma reacção química.
A transformação das substâncias
químicas em outras (reacções químicas) é representada através de uma linguagem
adoptada pelos químicos e que é designada de equação química.
Equação química é a representação gráfica de uma reacção
química através de símbolos e fórmulas químicas (a transformação das substâncias).
Equação química:
Na equação química
apresenta-se à esquerda os reagentes
e à direita os produtos. A separar
os reagentes dos produtos coloca-se uma seta
que aponta para os produtos, que indica o sentido da transformação.
Tanto os reagentes
como os produtos são representados por meio de símbolos e fórmulas químicas,
separando-se cada substância da outra por meio do Sinal de adição (+). Entre os reagentes, o sinal (+) significa “reage com” e nos produtos, o Sinal (+)
significa “e”.
Em alguns casos, à direita
de cada substância, ao mesmo nível e deixando um espaço, indica-se o estado físico
de cada substância, onde o estado sólido
representa-se por (s), o estado líquido por (l), o estado aquoso (aq)
e o estado gasoso por (g).
Por exemplo, quando
reage a substância A, no estado sólido, com a substância B, no estado liquido,
para formar as substâncias C, no estado aquoso, e D, no estado gasoso,
representa-se pela seguinte equação:
A(s)
+ B(l) → C(aq) + D(g)
Em condições
adequadas, do contacto entre moléculas de hidrogénio, no estado gasoso, e de
molécula de oxigénio, também no estado gasoso, formam-se moléculas de água,
gasosas, conforme elucida a equação química abaixo, A propósito dos
coeficientes que aparecem antes de cada uma das substâncias falaremos mais
adiante.
2H2
(g) + O2 (g) → 2H2O (g)
Uma equação química
apresenta dois significados: um qualitativo e um quantitativo.
- Qualitativamente: a equação química indica-nos quais as substâncias que participam na reacção química, isto é, quais os reagentes e os produtos da reacção.
- Quantitativamente: a equação química indica-nos a quantidade de reagentes e de produtos da reacção, através dos coeficientes estequiométricos.
Na equação da reacção
acima (de formação da água):
- Qualitativamente, o hidrogénio, no estado gasoso, reage com o oxigénio, no estado gasoso, e o produto da reacção é a água, no estado gasoso.
- Quantitativamente, duas moléculas de hidrogénio (2H2) reagem com uma molécula de oxigénio (O2), formando-se duas moléculas de água (2H2O).
Bibliografia
AFONSO, Amadeu. Q8 – Química 8ª Classe. 2ª Edição. Texto Editores, Maputo, 2020.

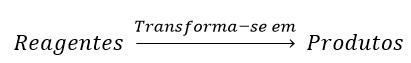



Comentários