Ligação Química: conceito, tipos, estrutura de lewis e regra de octeto e Tipos de Ligações Químicas
Conceito de
ligação química
Há milhares de anos que os cientistas vêm pensando na
pergunta: o que mantém unidos os átomos? Somente no decorrer dos últimos
cinquenta anos é que os cientistas realmente começaram a compreender a natureza
da ligação química.
Ligação química – é o conjunto de forças que mantém os átomos
unidos uns aos outros de modo a adquirirem a estabilidade química.
A ligação química surge graças à interação dos campos
eléctricos criados pelos electrões e pelos núcleos dos átomos que participam na
formação de uma molécula.
Toda ligação química forma-se porque a energia é menor
quando os átomos estão próximos uns dos outros. Os átomos ligam-se para, no seu
conjunto, ficarem com menos energia – com mais estabilidade.
O químico Gilbert Newton Lewis verificou que os átomos dos gases nobres, muito estáveis, tem a
camada de valência (último nível de energia) com 8
electrões ou 2 electrões,
no caso do hélio.
Assim, considerou-se que a tendência geral dos átomos dos
outros elementos é a de ficar com a configuração electrónica do gás nobre mais próximo,
isto é, com o seu nível de energia completo.
Regra do octeto – um átomo tem tendência a atrair ou ceder
electrões até ficar com 8 electrões na sua última camada ou camada de valência,
excepto o átomo de hidrogénio que atrai mais 1 electrão.
Assim, os elementos químicos do primeiro ao sétimo grupo
(1 a 7 electrões na última camada, respectivamente), porque não estão estáveis,
desejam e procuram alcançar a estabilidade química. A forma que lhes leva a
estabilidade química é o estabelecimento de ligações químicas.
Estrutura de
Lewis e Regra do Octeto
O químico Gilbert Lewis propôs uma representação
esquemática para os átomos e moléculas, evidenciando a partilha de electrões,
que ficou conhecida como notação ou representação de Lewis.
Na notação de Lewis, os átomos de cada elemento são
representados pelo respectivo símbolo químico e os electrões de valência por pontos (●) ou
cruzes (x).
Numa molécula, os pares de electrões partilhados
representam-se por pares de pontos ou cruzes ou ainda por traços entre os
símbolos dos átomos, evidenciando a ligação. A representação por ● ou x
serve para diferenciar os electrões de um e de outro átomo, ainda que não se
distinga na molécula a que átomo pertence cada um dos electrões.
Feita a distribuição electrónica, os electrões de valência, na notação de Lewis,
são representados mediante a colocação de pontos ou cruzes em redor do símbolo
do elemento químico.
Geralmente procura-se agrupar os electrões aos pares
(dois a dois). Na formação das moléculas os electrões de um átomo são
emparelhados com os do outro constituindo pares electrónicos de ligação.
Exemplos:
Noção sobre
ião, sua formação e classificação
Um átomo é electricamente neutro, isto é, tem igual
número de cargas positivas (protões) e de cargas negativas (electrões). Um
átomo pode deixar de ser neutro quando cede ou capta electrões,
transformando-se num ião.
Ião é um átomo que cedeu
ou captou electrões ou é uma partícula portadora de carga eléctrica.
Existem iões positivos (catiões)
e iões negativos (aniões):
- Quando
os átomos (ou grupos de átomos) ganham electrões, ficam com excesso de carga
eléctrica negativa e formam iões negativos. Exemplos: F–, O2–,
NO3–.
- Quando
os átomos (ou grupos de átomos) perdem electrões ficam com deficiência de carga
eléctrica negativa e formam iões positivos. Exemplos: Na+, Al3+,
H3O+.
Iões
positivos ou catiões
Os catiões formam-se quando um átomo perde um ou mais electrões,
resultando num sistema eletricamente positivo, em que o número de protões é
maior que o número de electrões.
Exemplo: o átomo
de magnésio (Mg), que apresenta Z = 12, temos:
Iões
negativos ou aniões
Os aniões formam-se quando um átomo ganha ou
recebe um ou mais electrões, resultando num sistema eletricamente negativo, em
que o número de protões é menor que o número de electrões.
Exemplo: o átomo
de Flúor (F), que apresenta Z = 9, temos:
9F: p = 9 ⇒ 9 cargas positivas = +9 9F–:
p = 9 ⇒ 9 cargas positivas = +9
e = 9 ⇒ 9
cargas negativas = –9 e = 10 ⇒ 10 cargas negativas = –10
Tipos de
Ligação Química
Os principais tipos de ligação química conhecidos são: ligação iónica, ligação covalente e ligação metálica.
Ligação
iónica
A ligação iónica é uma ligação
química que ocorre por transferência de electrões e atracção entre iões de
sinais contrários.
A ligação iónica é estabelecida quando os átomos
intervenientes forem um metal e um não-metal (ametal).
São compostos típicos com ligação iónica os halogenetos
dos metais alcalinos, como, por exemplo: Na+Cl-, K+Cl-,
etc.
Estrutura e propriedades de substâncias iónicas
Os
compostos iónicos no estado sólido têm uma rede cristalina iónica como mostra a
figura.
- Os
cristais iónicos são maus condutores eléctricos, porém, quando fundidos ou em
água, os iões adquirem mobilidade e conduzem a corrente eléctrica.
- Os
compostos iónicos possuem pontos de fusão relativamente elevados.
- O
cristal iónico evidencia uma grande estabilidade resultante da interacção entre
os iões positivos e os iões negativos ao longo de toda a rede cristalina.
Ligação Covalente
A ligação covalente consiste na partilha de pares de
electrões entre dois átomos de elementos não-metálicos, com a finalidade de
adquirirem estabilidade (com 8 electrões na última camada).
Ligação covalente – é aquela que ocorre
por compartilhamento de electrões entre os átomos não metálicos dos elementos
envolvidos na ligação.
A ligação covalente pode ser de dois tipos, a ligação
covalente apolar e ligação covalente polar.
Ligação covalente apolar é aquela que ocorre entre átomos
não-metálicos (ametálicos) do mesmo elemento químico.
Exemplo: H2, O2, Cl2, N2,
etc.
Ligação covalente polar é aquela que ocorre entre átomos
não-metálicos (ametálicos) de elementos químicos diferentes.
Exemplo: HF, NH3, CO2, H2O, etc.
Propriedades das substâncias covalentes
As ligações covalentes são ligações muito fortes, o que
justifica que, em regra, os sólidos covalentes apresentam:
- Elevada
dureza.
- Pontos
de fusão muito elevados.
- Não
conduzem corrente eléctrica.
Ligação
Metálica
Os metais são
substâncias geralmente sólidas à temperatura ambiente (com excepção do
mercúrio, que é líquido) cujas propriedades estão relacionadas com a forma como
os átomos estão ligados.
Os átomos dos metais têm poucos electrões de valência e
estes estão fracamente ligados ao núcleo. Por essa razão, os átomos dos metais
perdem esses electrões facilmente originando iões positivos ou catiões.
Os electrões de valência dos metais são considerados electrões livres e vão-se movendo entre os
átomos, estando sob acção simultânea de vários núcleos, ou seja, os electrões
movem-se mais ou menos livremente por todo sólido.
Assim, os metais são formados por um conjunto de iões
positivos, que ocupam posições fixas e por electrões livres, que se deslocam
entre os iões positivos e que interagem com estes.
Propriedades das
substâncias com ligação metálica
- São
bons condutores da corrente eléctrica.
- São
bons condutores térmicos.
- São
maleáveis (mudam de forma sem se partir).
- São
dúcteis (podem se esticar, reduzir a fio sem se quebrar).
SILVA, Filomena Neves. Q9 – Química 9ª Classe. 2ª Edição. Texto Editores, Maputo, 2017.



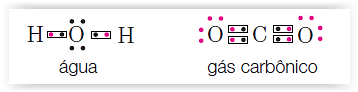
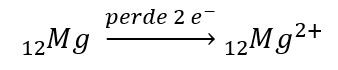
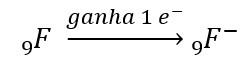



Comentários