HISTÓRIA DA TABELA PERIÓDICA e ORGANIZAÇÃO DA TABELA
HISTÓRIA DA TABELA PERIÓDICA
As primeiras tentativas de classificação dos elementos
químicos não iam mais longe do que o agrupamento de elementos, dividindo-os em
grupos com base nas semelhanças das suas propriedades químicas. Além disso,
cada elemento era examinado isoladamente, sem ligação com os outros elementos.
A primeira tentativa de classificação foi feita por Lavoisier, francês, (1789) e incluía 33
substâncias. Esta classificação deixava de fora a maior parte dos elementos
conhecidos na altura, o que revelava quanta imperfeição havia nos conceitos
daquele químico.
Em 1812, Jacob Berzelius,
sueco, apresenta uma tabela com 42 elementos, baseada em analogias de
propriedades físicas e químicas dos elementos, dividindo-os em metais e
não-metais.
Johann Dobereiner (1780-1849), alemão, em 1829 descobre a disposição dos
elementos em tríades e formula a lei das tríades, segundo a qual: «Existem
grupos de três elementos cujos pesos atómicos formam uma progressão
aritmética».
O cientista John Newlands (1837-1898), químico inglês, em
1866 formula a lei das oitavas: «Dispondo os elementos em sequência
crescente de pesos atómicos, o primeiro torna-se semelhante ao oitavo,
repetindo-se o facto em intervalos regulares».
Li Be B
C N O
F
Na Mg Al
Si P S
Cl
Lothar Meyer, químico alemão, descobre a regularidade nas
propriedades como a condutibilidade como a condutibilidade para o calor e a
electricidade.
Dimitri Ivanovich
Mendeleev, dispondo os elementos segundo a sequência crescente dos
seus pesos atómicos, conseguiu:
- Dispor os elementos em harmonia com a semelhança das suas
propriedades.
- Prever os espaços vazios na Tabela Periódica, com vista a
colocar elementos ainda por descobrir.
Assim, Mendeleev,
químico russo, em 1869, formula a lei periódica:
“As propriedades dos
elementos são uma função periódica dos seus pesos atómicos (massas atómicas)”.
Em 1914, Moseley, cientista inglês, verifica que o
número atómico (Z) é a característica principal do elemento químico e reformula
a lei periódica.
“As propriedades dos elementos químicos são uma função periódica dos seus números atómicos.”
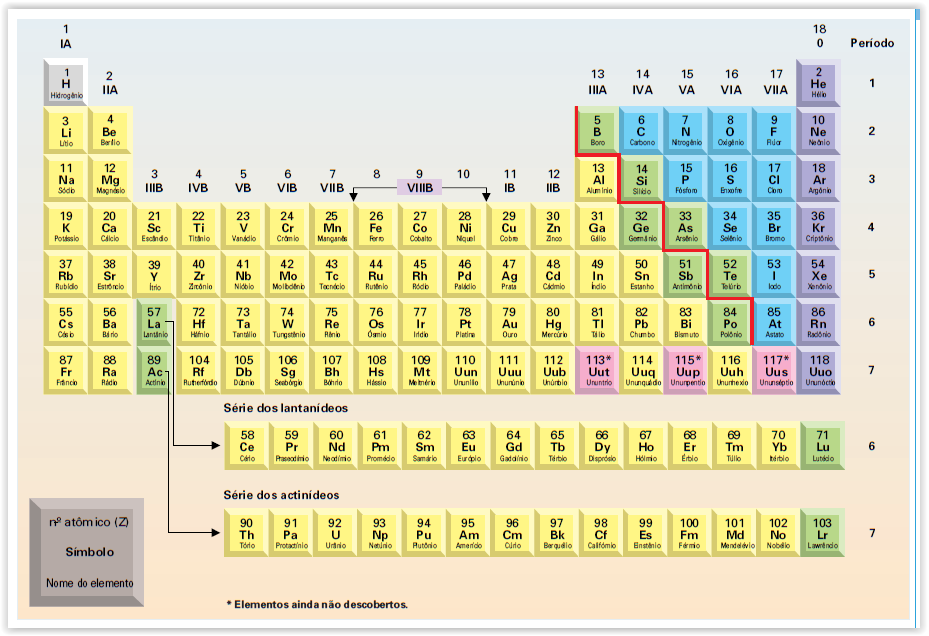
TABELA PERIÓDICA
A tabela ou quadro
periódico dos elementos é um
sistema onde os elementos químicos estão ordenados segundo a ordem crescente
dos seus números atómicos. Existem
actualmente 117 elementos químicos.
 |
| Tabela Periódica |
A Tabela Periódica é constituída por grupos e períodos. Os grupos correspondem a ordenação vertical dos elementos.
Existem na tabela oito (8) grupos principais (Grupos A) e
oito (8) grupos secundários (Grupos B). A União Internacional da Química Pura e
Aplicada (IUPAC) recomenda a numeração dos grupos de 1 a 18.
Os grupos, também designados por família são
representados por numeração romana e alguns têm denominação especial.
- O
grupo IA é chamado grupo dos metais alcalinos;
- O
grupo IIA é chamado grupo dos metais alcalinos
terrosos;
- O
grupo VIA é chamado grupo dos calcogéneos;
- O
grupo VIIA é chamado grupo dos halogéneos;
- O
grupo VIIIA é chamado grupo dos gases nobres ou gases raros
ou ainda gases inertes.
Os elementos dos grupos A são chamados de Elementos Representativos. Os elementos dos
grupos B, são chamados por Elementos de Transição.
Os períodos são a ordenação horizontal dos elementos
químicos. A tabela periódica apresenta sete períodos.
Em geral os períodos não apresentam designações
especiais, mas as duas últimas ordenações horizontais têm a designação Lantanídeos e
Actinídeos
e estas ordenações pertencem ao 6º e 7º períodos, respectivamente.
Em cada um dos lugares da tabela é indicado o símbolo
químico do elemento e outras informações relativas a esse elemento, como nome,
número atómico e massa atómica relativa.
Nas linhas horizontais da tabla, ou períodos, os
elementos estão organizados em metálicos e não metálicos. Os elementos que se encontram
destacados junto à linha separadora dos metais e não metais são conhecidos por semimetais, uma vez que têm caracteristicas
intermédias entre metais e não metais.
O hidrogénio que é o elemento de número atómico menor (Z
= 1) e, portanto, o primeiro elemento da Tabela Periódica, tem m lugar à parte na tabela; é um elemento
que, apesar de aparecer muitas vezes colocado no grupo 1, não pertence a ele,
pois não é metal. Há quem o coloque
neste grupo por ter apenas um electrão de valência, tal como acontece com os
metais alcalinos. Por outro lado, tem características de não-metal.
SILVA, Filomena Neves. Q9 – Química 9ª Classe. 2ª Edição. Texto Editores, Maputo, 2017.




Comentários