História da teoria atómica: Modelo atómico de Dalton, Thomson, Rutherford e Bohr
História da teoria atómica
Nem sempre o ser humano pensou que o átomo é como o
conhecemos actualmente. Foi uma ideia que evoluiu ao longo dos anos. Apesar do
primeiro modelo atómico ter sido apresentado já no século XIX, a ideia de que a
matéria é feita de pequeníssimos corpúsculos surgiu há muito, muito tempo.
Na Grécia Antiga, século V a. C., o filósofo grego
Leucipo e seu discípulo Demócrito imaginaram a matéria como sendo constituída
por pequeníssimas partículas indivisíveis – os átomos, como lhes chamaram.
Concluíram que a matéria não poderia ser infinitamente divisível. Se a
partíssemos várias vezes, chegaríamos a uma partícula muito pequena,
indivisível e impenetrável a que se denominou átomo.
Esta é uma palavra de origem grega que deriva de a + thomos, que significa “sem
divisão”. Era uma ideia muito avançada
para esta altura, mas não havia possibilidade de fazer observações que a
pudessem apoiar.
Só muito mais tarde, com a evolução da tecnologia é que
foi possível obter evidências experimentais.
Assim, esta ideia de que os átomos seriam pequenas
partículas indivisíveis perdurou mais de vinte séculos.
Como é o átomo? De que é feito? São questões que levaram
ao desenvolvimento de diferentes teorias que são conhecidas por modelos atómicos.
Modelo atómico de Dalton
John Dalton viria a apresentar um primeiro «modelo» para
o átomo. Para Dalton, o átomo era uma pequena esfera maciça, constituinte de
toda a matéria.
A teoria atómica de Dalton assentava nas seguintes
hipóteses:
- A matéria era formada por partículas muito
pequenas designadas por átomos.
- Os átomos eram indivisíveis e indestrutíveis.
- Os átomos de um mesmo elemento eram iguais.
- Os átomos de elementos diferentes eram
diferentes.
- Os átomos de diferentes elementos combinavam-se entre si formando compostos.
Fig. 1 – Modelo atómico de Dalton
Modelo atómico de Thomson
Entretanto, no fim do século XIX determinou-se uma série
de factos que esclareciam a estrutura composta dos átomos e a possibilidade de
se transformarem. Trata-se, em primeiro lugar, da descoberta do electrão
pelo físico inglês Joseph Thomson, em 1897. Para Thomson, o átomo teria o
aspecto de um «pudim (bolo) de passas», seria uma esfera maciça
de carga positiva, uniformemente distribuída, onde se encontrariam espalhados
os electrões com carga negativa.
Depois de vários estudos, concluiu-se que os electrões apresentavam carga negativa. No entanto, os átomos não possuem carga eléctrica, são electricamente neutros. Concluiu-se, então, que os átomos continham, para além dos electrões, partículas com carga positiva. Por outras palavras, os átomos são formações compostas que se constroem a partir de unidades estruturais mais pequenas.
Fig. 2 – Modelo atómico de Thonsom
Modelo atómico de Ruttherford
Para examinar a hipótese de Thomson e para determinar com
maior exactidão a estrutura interna do átomo, Rutherford realizou uma série de
experiências e em 1911 propôs o modelo nuclear do átomo, segundo o qual o átomo
é composto por um núcleo carregado positivamente, no qual está concentrada a
parte dominante da massa do átomo e por electrões que giram em volta dele em
órbitas circulares bem definidas, tal como os planetas em volta do Sol (modelo
planetário).
A carga positiva do núcleo é compensada pela carga negativa, resultante dos electrões, de modo que o átomo no seu todo é neutro. Portanto, o número de protões no núcleo é igual ao de electrões, daí o átomo passa a ser um sistema electricamente neutro (p+ = e–).
Fig. 3 – Modelo atómico de Rutherford
Contudo, o modelo atómico de Rutherford, apesar de
inovador, continha algumas limitações que irá estudar mais tarde.
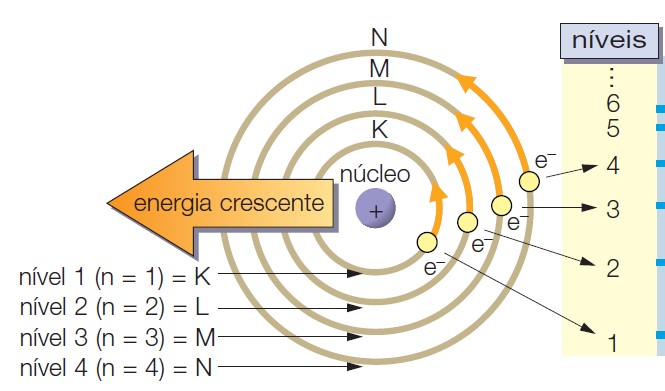
Modelo atómico de Bohr
Partindo do modelo nuclear do átomo de Rutherford, em
1913, o físico dinamarquês Niels Bohr adoptou uma analogia com o sistema solar,
com os electrões a descreverem órbitas em torno do núcleo, mas acrescentando
que só determinadas órbitas seriam possíveis, correspondendo maior energia aos
electrões que descreviam órbitas com raios maiores. Este modelo, apesar de
apresentar limitações, seria importante para o desenvolvimento de conceitos da
estrutura atómica.
Para Bohr os electrões não podem ser encontrados entre as
órbitas, porém, pode saltar de uma Orbita para outra mediante absorção ou perda
de energia.
Com efeito chamou às órbitas de níveis de energia (n) que correspondem às camadas que são representadas por letras K, L, M, N, O, P, Q.
 |
| Modelo atómico de Bohr |
SILVA, Filomena Neves. Q9 – Química 9ª Classe. 2ª Edição. Texto Editores, Maputo, 2017.





Comentários